診療科・部門
治験管理センタ-
概要
治験管理センタ-は、患者さんのご協力により「くすりの候補」を使用していただき、患者さんに「治験」を円滑にまた、適正に行うことができるように、「治験」に関わる業務を行う部門です。医師の他に病院職員以外の方も含めた多くのスタッフが関わっており、医療チ-ムとして活動しています。
問い合わせ先
連絡先:豊橋市民病院 治験管理センタ-
対応時間:平日(月~金) 午前8時30分から午後5時
TEL:0532-33-6111(代表)
業務紹介
スタッフ
| センター長 | 成瀬 賢伸(副院長) |
|---|---|
| 事務局長 | 白井 景(薬局長) |
| CRC責任者 | 石川 英子(薬局次長) |
治験には、医師の他にも多くのスタッフが関わります。当院では治験管理センターという部門があり、チームとして活動しています。
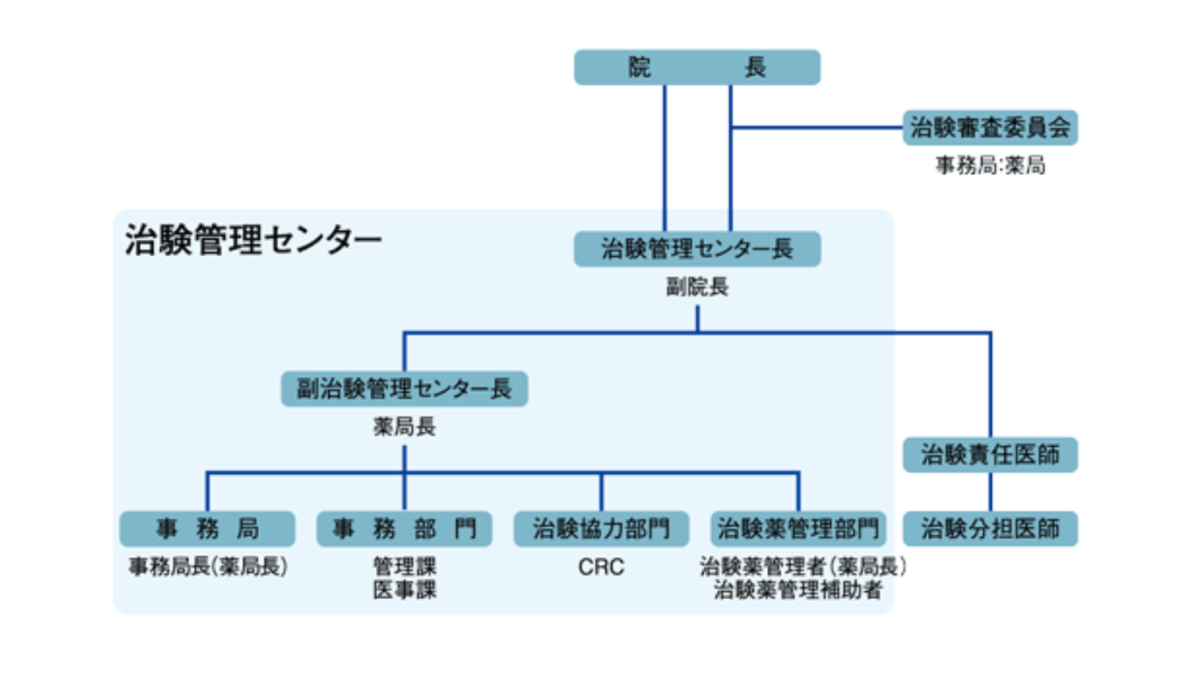
- 「治験管理センター」とは治験に関する業務を適正かつ円滑に行うための部門をいいます。
- 「治験審査委員会」とは治験についての審議を行い、参加される患者さんの人権と安全性に問題がないかを審査するところです。委員会には病院職員以外の方も審議に参加しています。
- 「治験責任医師」は治験の実施に関して責任を有する医師または歯科医師で、治験を中心となって適正に行っていきます。
- 「治験分担医師」は治験責任医師に協力して治験を実施します。
- 「CRC(治験協力者)」は治験責任医師または治験分担医師の指示のもとで治験の実施に協力するスタッフです。患者さん、治験依頼者、医師の間に立って治験を円滑に進めていきます。
治験審査委員会(IRB)
当院で治験を行う場合は、治験審査委員会と呼ばれる委員会で、治験を実施することが倫理的、科学的及び医学的・薬学的に妥当かどうか検討し、その承認を得ています。また、治験について新しい重要な情報が得られた場合や治験担当医師、その他変更事項が生じた場合は、治験を継続して良いかを検討し、治験が適切に実施されていることを確認する役割があります。
治験審査委員会は、原則年8回(5、6、8、9、11、1、2、3月)開催しています。開催予定の1カ月前までに受け付けたものは、直近の治験審査委員会で審査します。
治験協力者(CRC)
「治験」を円滑に行うために、「治験」を実施する医師(治験責任医師、治験分担医師)の指示のもとで「治験」に協力して患者さんをサポ-トするスタッフを「治験協力者(CRC)」といいます。患者さんにはCRCが詳しく「治験」の内容やスケジュ-ルなどを説明させていただきます。「治験」の参加にあたっては患者さんのプライバシ-は守られます。また患者さんへのサポ-ト体制も整っていますので、「治験」に関してわからないことや、詳しく知りたいことがありましたら治験管理センタ-のCRCにお申し出ください。
治験開始
- 看護師に治験内容の説明
- 治験依頼者(製薬会社)への登録作業の補助
- 患者さんへの同意取得の補助説明
- 患者さんへ治験参加証の交付
治験実施中
- 検査の実施及び検査項目の確認
- 担当医師への連絡(投薬、検査などのスケジュール)
- 治験薬処方オーダーの確認
- 患者さんへの治験薬の投薬及び服薬指導(服薬状況、併用薬、副作用などの確認、スケジュールの説明)
- 患者さんのスケジュール管理
- 治験依頼者(製薬会社)との連絡などの対応
- 残薬の確認及び回収
治験終了
- 医師が記載する症例報告書の記入補助(検査値などの転記作業)
- 国や治験依頼者(製薬会社)によるモニタリング・監査などの対応(カルテの準備など)
治験について
治験とは
製薬会社が開発した新しいくすりを病院などの医療施設で使用するには、事前に、国に認可してもらうことが法律で義務づけられています。そのためには認可される前の「くすりの候補」を、実際に医療施設で患者さんに投与することにより、安全性と有効性(効果)などを確かめる必要があります。この「新薬開発」のために「治療を兼ねた試験」のことを「治験」といいます。
治験はなぜ必要か
もしも「人間」で有効性や安全性が確かめられずに、新しい候補のくすりが世の中に出て使用された場合、予期しない副作用が発生して多くの人に被害をもたらしかねません。また、効かないくすりであったなら、投与により、患者さんは他の有効な治療を受ける機会を奪われることになります。そして無駄な時間を費やすことになります。したがって、くすりが世に出る前に、有効性や安全性を慎重に確認する「治験」が必要となります。
治験のルール
治験に参加していただく方の権利や安全が守られるよう、また、「くすりの候補」の効き目や副作用が科学的な方法で調べられるよう、治験は国が定めた大変厳格なルールに従い実施されます。
治験のしくみ
「くすり」は多くの人々の生命や健康を支えてきました。しかし、今も、充分な治療薬のないさまざまな病気があり、そのため、新しい「くすり」を開発する努力が世界中で続けられています。
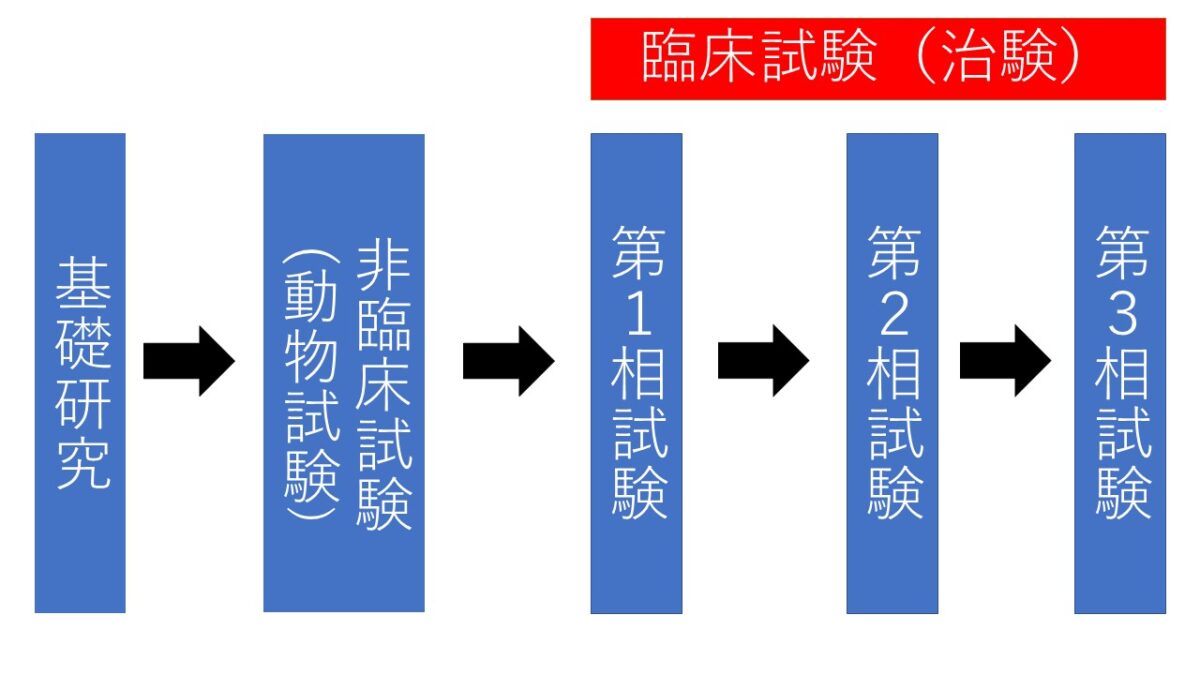
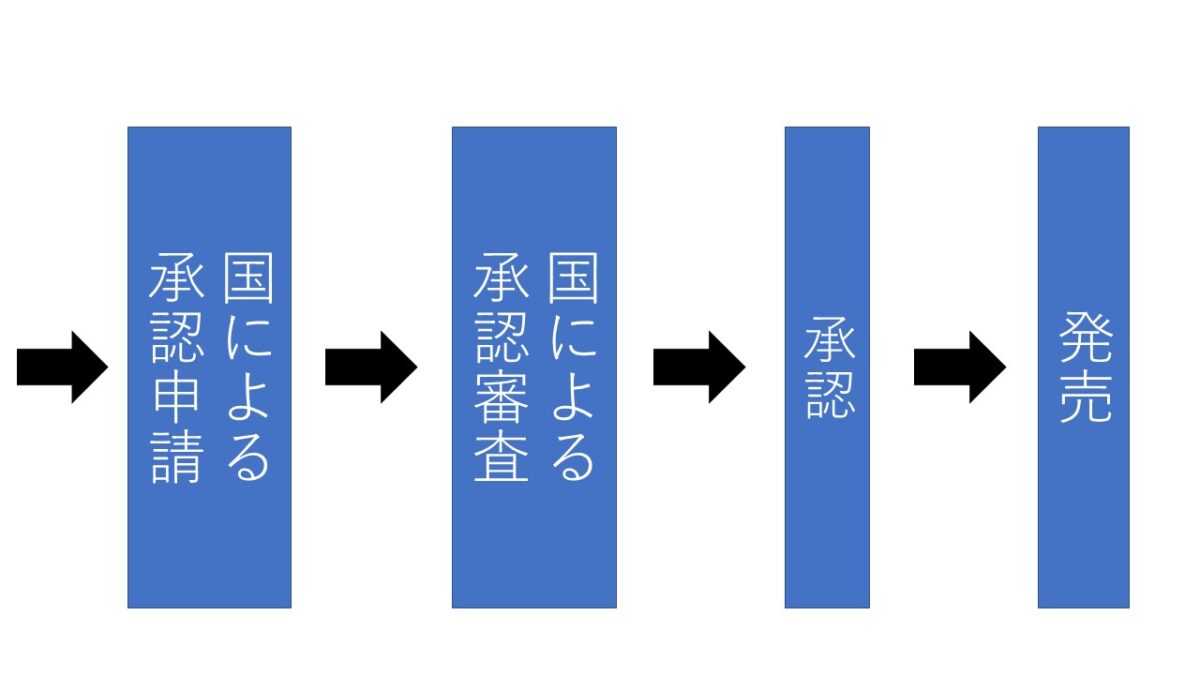
「くすり」は、以下に示す多くのステップを踏んでから世の中に出て来ます。実際に「くすり」となるのはごくわずかで、約10~15年かかって「くすり」として認められます。
基礎研究
新しい「くすり」の開発は、製薬企業などの研究室で化学的に合成されたり、天然に存在している物質から抽出されたりした、何千という化合物から、目的とする作用を持ったいくつかの物質を選び出すところから始まります。
非臨床(動物)試験
次に、ネズミ、ウサギ、イヌなどの動物を使って、効果(有効性)と毒性(安全性)をくわしく調べ、「くすり」になりそうだと見込まれるものだけが「くすりの候補」として残されます。
臨床試験(治験)
最後に、「くすりの候補」が人でどのような効き目や副作用を示すかが調べられます。人と動物では、それらの現れ方が違うからです。
また、日本人と外国人では違いがでることがあるため、外国ではなく日本での治験が必要となります。
臨床試験(治験)では、以下の第1相試験から第3相試験を行います。
第1相試験
少数の健康成人などに、主に安全性や薬の吸収、排泄などについて調べる試験です。
第2相試験
比較的少数の患者さんについて有効性、適切な投与量と安全性などを調べる試験です。
第3相試験
多数の患者さんについて、すでに使用されている「くすり」などと比較して有効性と安全性を比較する試験です。
治験への参加
1.医師は条件にあった患者さんに治験参加を依頼し、治験内容を説明します。また、必要があれば、治験協力者(CRC)がより詳しく治験の内容や治験のスケジュールなどを説明します。
2.患者さんは、治験の内容をよく理解した上で、参加を自分の意思で決めます。そして、参加に同意した場合は、同意説明文書に署名をします。また、同意した後いつでも患者さんの意思で参加を取り消すことができます。
3.治験が開始されると、患者さんは服薬を守り、スケジュールに従って診察や検査を受けます。医師は治験中、患者さんの状態を観察し、副作用などに注意していきます。なお、治験の参加にあたっては患者さんのプライバシーは守られます。 患者さんへのサポート体制も整っています。また、治験期間中に実施された検査などの費用は免除されます。
4.スケジュールどおり期間が過ぎると治験は終了します。
現在使用されている「くすり」も、患者さんの協力により誕生したものです。医師より、治験の依頼があった際には、さらに良い「くすり」を世に送り出すためにも、協力していただきたいと考えています。治験について詳しく知りたい方は、治験管理センターの治験協力者(CRC)にお申し出ください。
連絡先:豊橋市民病院 治験管理センター TEL:0532-33-6111(代表)
平日(月~金) 午前8時30分から午後5時
治験依頼者(製薬会社)へ
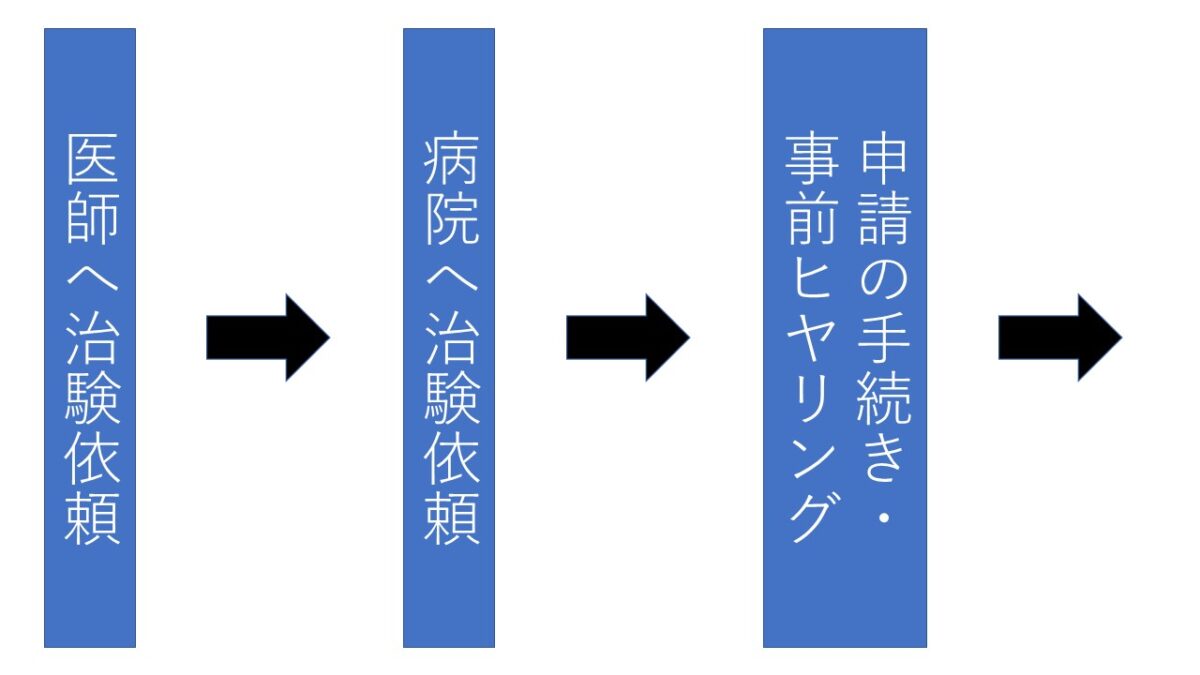
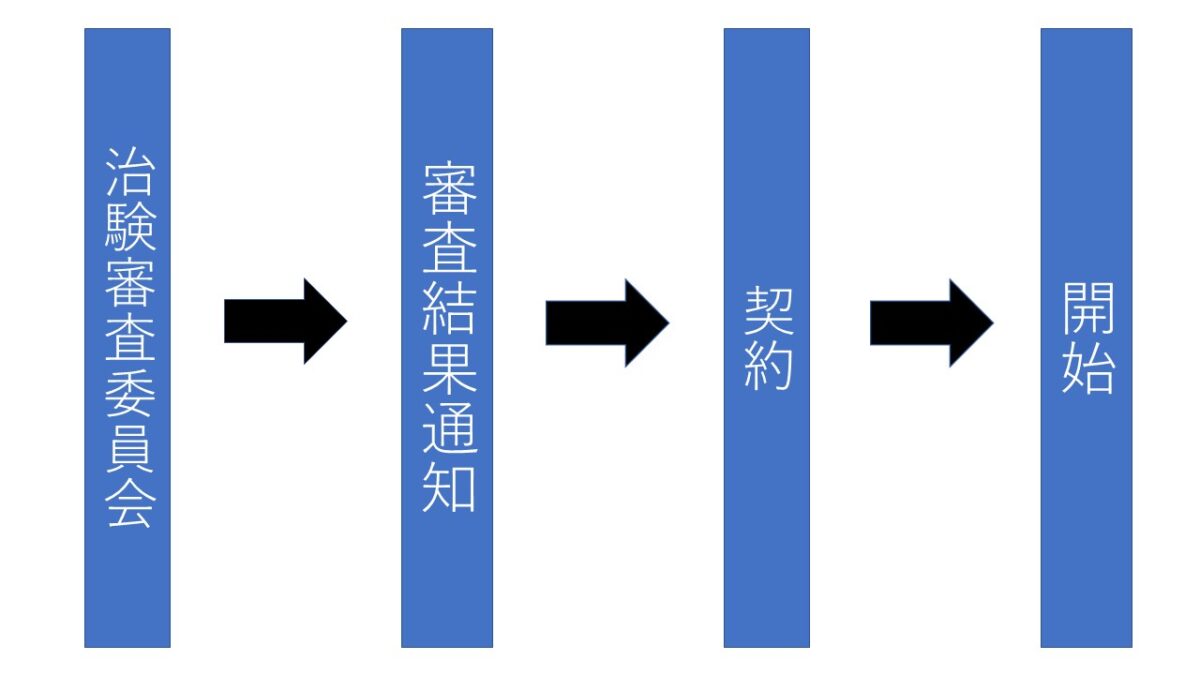
治験依頼者が治験を申し込む場合は、治験管理センター(薬局内)で説明を受けた後、必要な書類を提出し、申請する。
標準業務手順書等
書式・様式等
書式は、厚生労働省の通知に基づく「治験の依頼等に係る統一書式」をご使用ください。
治験審査委員会は、原則年8回(5、6、8、9、11、1、2、3月)開催しています。開催予定の1カ月前までに受け付けたものは、直近の治験審査委員会で審査します。
